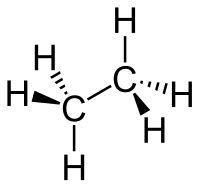
Ethan
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeen | ||
| Naam | Ethan | |
| Annere Naams | Äthan | |
| Summenformel | C2H6 | |
| CAS-Tall | 74-84-0 | |
| Kortbeschrieven | Gas ahn Klöör | |
| Egenschoppen | ||
| Molar Masse | 30,07 g·mol−1 | |
| Phaas | gasförmig | |
| Dicht | 1,36 g·l−1 (0°C, 1013 mbar)[1] 0,54 g·cm−3 (fletig, an’n Kaakpunkt)[1] | |
| Smöltpunkt | -183 °C[1] | |
| Kaakpunkt | -89 °C[1] | |
| Dampdruck | 3,8 MPa[1] (20°C) | |
| Löslichkeit |
so goot as nich löslich in Water[1] | |
| Sekerheitshenwiesen | ||
| Gefahrstoffkennteken ut RL 67/548/EWG, Anh. 1 | ||
|
| ||
| R- un S-Sätz | R: 12 | |
| S: (2)-9-16-33 | ||
| Wietere Sekerheitshenwiesen | ||
| MAK | Weert fehlt | |
| Sowiet mööglich un tyypsch, warrt dat SI-Eenheitensystem bruukt. Wenn nich anners anmarkt, gellt de angeven Daten bi Standardbedingen. | ||
Ethan oder Äthan is en cheemsche Verbinnen ut de Stoffgrupp vun de Alkanen (sättigte Kohlenwaterstoffen). De Verbinnen is en Gas ahn Röök un ahn Klöör, dat vör allen to’n Hitten un Böten bruukt warrt. Afleidt vun Ethan is de Ethylgrupp (–C2H5). Blangen Methan is Ethan en Hööftbestanddeel vun’t Eerdgas.
Egenschoppen ännern
Ethan is ünner Normalbedingen gasförmig. De Smöltpunkt liggt bi −182,76 °C, de Kaakpunkt bi ruchweg −88,6 °C. In Water löst sik Ethan bannig slecht mit 61 mg/l (bi 20°C). To’n Smölten warrt 583 J/mol bruukt, to’n Kaken sünd 10 kJ/mol nödig.
Dat gifft twee Konformatschonen vun’t Ethan, de sik in de Energie üm ruchweg 12,6 Kilojoule pro Mol ünnerscheeden doot. Man seggt ok Torsionsenergie dorto. In de ekliptischen Konformatschoon is de Energie an’n hööchsten, wat ehr unbestännig maakt. In de staffelten Konformatschoon is se sieter, so dat disse Form energeetsch vörtogen warrt. De Energie vun all annere Konformatschonen liggt twüschen disse beiden Extremweerten.
De Torsionsenergie vun’t Ethanmolekül is bi Ruumtemperatur gegenöver de thermischen Energie lütt. Dat Molekül is dorüm jümmer an’t Roteren üm de C-C-Ass. In regelmatige Tietrüüm kummt dat aver to en Oort „inrasten“ in de staffelte Konformatschoon, so dat sik to jede Tiet ruchweg 99 % vun de Molekülen in de Neeg vun’n Energieminimum befinnt. De Övergang twüschen twee staffelte Komformatschonen duert in’n Dörsnitt 10−11 Sekunnen.
De Struktur vun’t Ethanmolekül wiest Tetraederwinkels op, also 109,5°. De Binnenläng twüschen de beiden C-Atomen is ruchweg 154 pm, twüschen en C- un en H-Atom sünd dat blots 109 pm.[2]
Vörkamen un Dorstellen ännern
| Planet | Ethanandeel |
|---|---|
| Jupiter | 5,8 ± 1,5 ppm |
| Saturn | 7 ± 1,5 ppm |
| Neptun | ~1,5 ppm |
In’t Eerdgas un in Sumpgas kummt Ethan in teemlich grote Mengden vör. In de Eerdatmosphäär dorgegen gifft dat blots Sporen vun dat Gas. Dat Methan un Ethan op de Eer in vergliekswies grote Mengde op de Eer vörkamt liggt vör allen an de Leevwesens un an den Verfall vun orgaansche Stoffen. Man, de Gasen entstaht ok ahn Biwesen vun Leevwesen ut Waterstoff un Kohlenstoff, vunwegen dat dat teemlich eenfache Verbinnen sünd.
Sporen vun Ethan sünd ok op de groten Planeten Jupiter, Saturn un Neptun to finnen. Op de annern Planeten is keen Ethan nawiest worrn, dorför aver op eenige Kometen – as in de Koma vun den Komeet Hale-Bopp. Allgemeen is dat Vörkamen vun Ethan in’t Weltall aver lütt un nich to verglieken mit dat Vörkamen vun Methan. In Sporen is Ethan ok op verschedene Maanden funnen worrn, as op den Saturnmaand Enceladus. 2008 is butendem publiek maakt worrn, dat de See Ontario Lacus op Titan vör allen mit Ethan füllt is.[3] ok op den Dwargplanet Pluto gifft dat Ethan in Form vun Ies.
Ethan kann in’t Labor dör de Kolbe-Elektrolyys vun Etigsüür oder Kaliumacetat herstellt warrn.
Bruuk ännern
Ethan warrt as Deel vun’t Eerdgas to’n Böten in Füeranlagen bruukt un hett en Hittweert vun 64 MJ/m3 (47 MJ/kg). In de cheemschen Industrie deent Ethan as Grundlaag för de Synthees vun Ethen, Etigsüer un annere Verbinnen. As Küllmiddel (R 170) warr tEthan in Klima- un Küllanlagen insett.
Reakschonen ännern
Ethan verbrennt ünner Idealbedingen mit Suerstoff to Kohlenstoffdioxid un Water (Redoxreakschoon).
Bi düchtig hoge Temperaturen (> 700 °C) warrt Ethan to Ethen un Waterstoff opsplitt.
Gefahren ännern
Bi’t Inaten föhrt Ethan to en Anstiegen vun de Aten- un Hartfrequenz. Wenn gröttere Mengden inatent warrt, löst dat Gas Doovheit in de Lidden ut, as ok Slaaplosigkeit, Tüdel, Koordinatschoons- un Gedächtnisverlust un Hyperventilatschoon. Vun Ethan kann een slecht warrn bit hen to’n Breken. Bito kann dat to’n Freren kamen, wenn Ethan uttreden deit, vunwegen dat dat Gas tomeist fletig lagert warrt.
Ethan is butendem brennbor un tünnert bannig licht. Bi Volumenandelen twüschen 2,7 bit 15,5 % billt Ethan explosive Mischen, wobi en Mischen mit 6,5 % Ethan an’n licht’sten tünnern deit. De Flammpunkt liggt bi −135 °C, de Tünnertemperatur bi 515 °C.
Borns ännern
- ↑ a b c d e f Indrag to Ethan in de GESTIS-Stoffdatenbank; afropen an’n 3. Oktober 2012
- ↑ J. L. Duncan, D. C. McKean & A. J. Bruce: Infrared spectroscopic studies of partially deuterated ethanes and the r0, rz, and re structures in Journal of Molecular Spectroscopy, Bd. 74 (3), 1979, S. 361–374, DOI=10.1016/0022-2852(79)90160-7
- ↑ DLR: Saturnmond Titan – Ströme und Seen aus flüssigen Kohlenwasserstoffen
