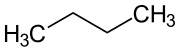
n-Butan
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeen | ||
| Naam | N-Butan | |
| Annere Naams | Weert fehlt | |
| Summenformel | C4H10 | |
| CAS-Tall | 106-97-8 | |
| Kortbeschrieven | Gas ahn Röök un ahn Klöör | |
| Egenschoppen | ||
| Molar Masse | 58,12 g·mol–1[1] | |
| Phaas | gasförmig | |
| Dicht | 2,71 g·l−1 (Gasdicht, 0 °C)[1] | |
| Smöltpunkt | −138,3 °C[1] | |
| Kaakpunkt | −0,5 °C[1] | |
| Dampdruck | 208 kPa[1] (20 °C) | |
| Löslichkeit |
slecht in Water (61 mg·l−1 bi 20 °C)[1] | |
| Sekerheitshenwiesen | ||
| Gefahrstoffkennteken ut RL 67/548/EWG, Anh. 1 | ||
|
| ||
| R- un S-Sätz | R: 12 | |
| S: (2)-9-16 | ||
| Wietere Sekerheitshenwiesen | ||
| MAK | 2400 mg·m−3, 1000 ml·m−3[1] | |
| Sowiet mööglich un tyypsch, warrt dat SI-Eenheitensystem bruukt. Wenn nich anners anmarkt, gellt de angeven Daten bi Standardbedingen. | ||
n-Butan is en gasförmig Alkan ahn Klöör, dat de graadlienige Struktur (CH3–CH2–CH2–CH3) vun de beiden Strukturisomeren vun’t Butan dorstellt. Dat annere Isomer is dat Isobutan CH(CH3)3 (ok Methylpropan).
Egenschoppen
ännernBi Ruumtemperatur un Normaldruck is n-Butan en Gas. De Smöltpunkt liggt bi −138 °C, de Kaakpunkt bi -0,5 °C. In Water lööst sik n-Butan so goot as gor nich. Dat Gas is brennbor. Bromwater un Lösen von Kaliumpermanganat veleert dör n-Butan nich jemehr Klöör. Jüst as annere Alkanen reageert dat Gas mit de Halogneen Chlor un Brom normalerwies nich. Man ünner Inwirken vun Licht billt sik fotocheemsch verschedene Chlorbutanen oder Brombutanen dör Radikalkedenreakschoon.
n-Butan is dichter as Luft un kann in hoge Kunzentratschoon narkotiseren oder to’n doodsticken föhren[1]. Dat Explosionsrebeet vun n-Butan liggt in de Luft twüschen de ünneren Explosionsgrenz vun 1,4 Vol.-% (33 g·m−3) un de böveren Explosionsgrenz vun 9,4 Vol.-% (231 g·m−3)[1].
Herstellen un Bruuk
ännernButan is en so nöömt Fletiggas, dat bi de Eerdööldestillatschoon anfallt un in Eerdööl as ok in Eerdgas vörkummt.
Bruukt warrt n-Butan to’n Herstellen vun 1,3-Butadien un Maleinsüür. Siet FCKW as Driefgas verboden sünd, warrt dat ok in Sprays insett, to’n Bispeel as Levensmiddeltosatzstoff E 943a[2]) In wesseln Andelen warrt Butan ok in Mischen mit Methylpropan un Propan as Brenngas to’n Kaken un Heizen för Tanks un Gasbuddels as ok in Füürtüüch insett. In Fletiggas mit Butanandeel warrt dat ok as Driefstoff för Bus un Auto bruukt.
Ofschoonst Butan hooch brennbor is, warrt dat ok wedder in Köhlschränk as Küllmiddel anwennt (ünner de Beteken R-600 oder R600a in’n Fall vun’t Isobutan) wegen dat Verbott vun FCKW, de de butere Ozonschicht vun de Eerdatmosphäär angriepen doot. As Küllmiddel in’t Freerrebeet is Butan nich egent wegen sien Kaakpunkt vun -0,5 °C.
Reakschonen
ännernÜnner ideale Bedingen oxideert Butan to Kohlenstoffdioxid un Water.
Missbruuk as Droog
ännernWgen sien sieten Pries un de hogen Verföögborkeit warrt Butan mitünner as Droog missbruukt. Dat Gas wirkt vergliekbor as Snüffelstoffen[3]. Dorbi kann dat to en Ünnerversorgen mit Suerstoff kamen, vunwegen dat sik dat dichtere Butan in de Lung afsett un dormit dat Volumen vun de Lung minnert warrt. Dat kann de Övergeven föhren un in’n slimmsten Fall to starken Schaden an’n Bregen. Bi en stark Anstiegen vun’n Bregendruck besteiht Gefohr för’t Leven. Togliek stiggt dorbi de Anfalligkeit för Rammanfäll. Dat Snüffeln vun Butan is sünners bi junge Lüüd in de Mood, wat liekers al bi’t eerste mol mit’n Dood ennen kann, wenn dat Gas överdoseert is[4][5].
Literatur
ännern- Geert Oldenburg: Propan – Butan. Springer, Berlin 1955.
Borns
ännern- ↑ a b c d e f g h i Indrag to Butan in de GESTIS-Stoffdatenbank; afropen an’n 23. November 2014
- ↑ ZZulV: Verornen över’t Tolaten vun Tosatzstoffen to Levensmiddeln to’n technologischen Sinn.
- ↑ Robert Ackermann: Der plötzliche Schnüffeltod. In: die tageszeitung. 19. Juni 2008.
- ↑ Stadtnachrichten Markdorf (schwaebische.de): 15-Jähriger stirbt nach Deo-Schnüffeln.; afropen an’n 10. Oktober 2011
- ↑ SpiegelOnline: Schnüffeln – Tödlicher Rausch aus der Dose vun’n 10. August 2010.
