Binnigkeit
De Binnigkeit (ok Binnweertigkeit) gifft de Tall vun Atombinnen an, de en Atom vun en cheemsch Element in een Molekülingahn kann. In de Lewis- oder Strukturformel warrt se dör de Tall vun de Valenzstreken utdrückt, de vun en Atom utgaht.
To’n Bispeel sünd de beiden Kohlenstoffatomen (C) in’t Ethan (C2H6) veerbinnig – d. h. se hebbt en Binnigkeit vun 4, vunwegen dat se veer Binnen opwiest. De Waterstoffatomen (H) hebbt dorgegen jümmer blots een Binnen un sünd dorüm eenbinnig. In’t Ammoniak (NH3) is dat Stickstoffatom (N) dreebinnig, wiel de Waterstoffatomen wedder eenbinnig sünd. In’t Formaldehyd (CH2O) kummt en Dubbelbinnen vör: de Kohlenstoff is hier wedder veerbinnig, de Waterstoff wedder eenbinnig un de Suerstoff (O) is tweebinnig.
-
Ethan
-
Ammoniak
-
Formaldehyd

De Binnigkeit warrt vör allen dör de Tall vun de eenfack besetten Atomorbitalen (AO) fastleggt. Eenfack besett hett hier, dat op dat Orbital blots een Elektron sitt. De Waterstoff bargt blots en eenfack besett s-Orbital (1s1) un is dorüm eenbinnig. Bi’n Stickstoff sünd dat dorgegen dree eenfack besette p-Orbitalen (1s2, 2s2, 2p3), de dat Element dreebinnig maakt.
Man, dorbi is to bedenken, dat dat ok cheemsche Elementen gifft, de dör Hybridiseeren vör’t Binnen in en energeetsch högeren Tostand bröcht warrt. Dor mutt denn de Tall vun de eenfack besetten Hybrid-Orbitalen tellt warrn. De Kohlenstoff is en Bispeel dorför, de in sien Grundtostand wegen sien beiden eenfack besetten p-Orbitalen (1s2, 2s2, 2p2) an sik tweebinnig weer. Vör’t Binnen warrt de Kohlenstoff aver to den Valenztostand (1s2, 2sp3) anregt un hett denn veer eenfach besette sp3-Orbitalen. Dormit warrt he veerbinnig.
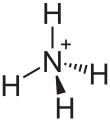
En wietere Utnahm stellt de Atomen dor, de fre’e Elektronenpoor bargt. Hier künnt disse fre’en Elektronenpooren för en Binnen insett warrn, wenn de beiden Elektronen vun’t Elektronenpoor in de Binnen mit ingaht. En Bispeel is de Stickstoff, de in’t Ammoniumion (NH4+) an veer Waterstoffatomen anbinnt, vunwegen dat he mit sien free Elektronenpoor en veerte Binnen maakt. Dormit is de denn veerbinnig.


